マネジメントブログ
ASCO抄録が公表されました
ブログの更新がしばらくできず、ご無沙汰してしまいました。
業務の多忙もありましたが、キャンバスの企業価値判断に影響を及ぼすと思われる今回の学会発表の前に何をどう書いても「裏の意味」「行間」を「自信の(あるいは自信のなさの)表れ」などと解釈され、それが株価等へ影響してしまうのを避けるためでもありました。ご容赦ください。
さて、本日公表したとおり、2020年米国臨床癌学会(ASCO)年次会議でポスター発表するCBP501フェーズ1b試験中間解析結果の抄録(アブストラクト)がASCOウェブサイトに公開されました。
https://meetinglibrary.asco.org/record/188996/abstract
この抄録には、既に公表している用量漸増相のデータに加え、これまで公表していなかった拡大相の内容も、2020年1月9日までにデータを獲得できた症例について記載されています。
今回のブログで、概要をご説明します。
中間解析結果の概要
まず膵臓癌については、拡大相の投与13例中評価可能8症例のうち、4例で4ヶ月を超える病勢安定(SD)が観察されました。
病勢コントロール率50%です。
また、提携交渉等で重視されやすい無増悪生存期間(PFS)の中央値は4.2ヶ月、最終的な承認の際に最重要視される全生存期間(OS)の中央値は5.9ヶ月でした。
いずれも、8例中6例が3次治療以上(既治療歴2以上)であることを考慮すると、かなり良い数値であると考えています。
このことは、この記事の後半でもう少し詳しくご説明します。
次にMSS直腸大腸癌ですが、2020年1月9日時点の拡大相評価可能症例数は4例にとどまりました。
それでは少なすぎて傾向をつかめないため、用量漸増相の症例や評価不能となった症例を含む10症例を対象として解析しています。
この10症例において、全生存期間(OS)の中央値は17.5ヶ月でした。
(MSS直腸大腸癌のSDやPFSについては今回の抄録には掲載されていません。)
これについても、10症例すべてが3次治療以上(=既治療歴2以上)であることを考慮すると、かなり優秀な数値と考えています。
2019年8月の決算説明会資料から、「フェーズ1b拡大相試験 成功のカテゴリー」のページを下に示しました。
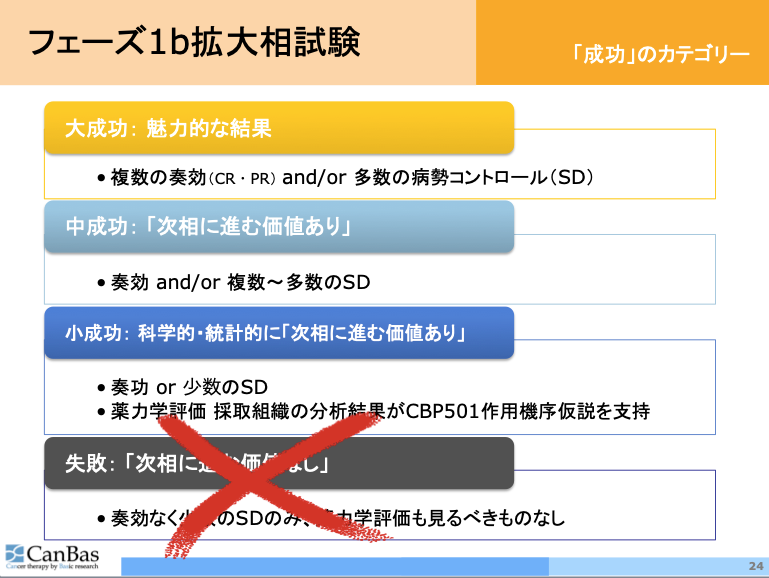
今回の抄録で公表した中間結果をこの分類に当てはめるならば、CBP501フェーズ1b試験は現在「中成功」と呼べる状況には到達していると考えています。
少なくとも、次相の臨床試験に進む価値を第三者専門家に理解させるには十分な水準であると思われます。
それを自社のリスクで進めたくなるかどうかは各社の経営判断に委ねざるを得ませんが、それは「大成功」であったとしても同じです。
キャンバスでは、この成果を踏まえて、具体的な提携獲得活動や今後の開発の準備を進めています。
膵臓癌のOSを他の臨床試験と比較する
ここで、以前の短期集中連載「臨床試験データ比較検討の現場をお見せします」の最終回で予告したままになっていたので、今回の中間解析データで着目していただきたい「全生存期間」(OS)について、膵臓癌の他の臨床試験との比較をご覧いただきます。
少しわかりにくいかもしれませんが、これをお読みいただくと、私たちが現在までのデータに自信を抱いている理由をご理解いただけると思います。
下の図は、CBP501フェーズ1b試験中間解析結果との比較に適すると考えられる他の臨床試験で示された全生存期間(OS)を図示したものです。
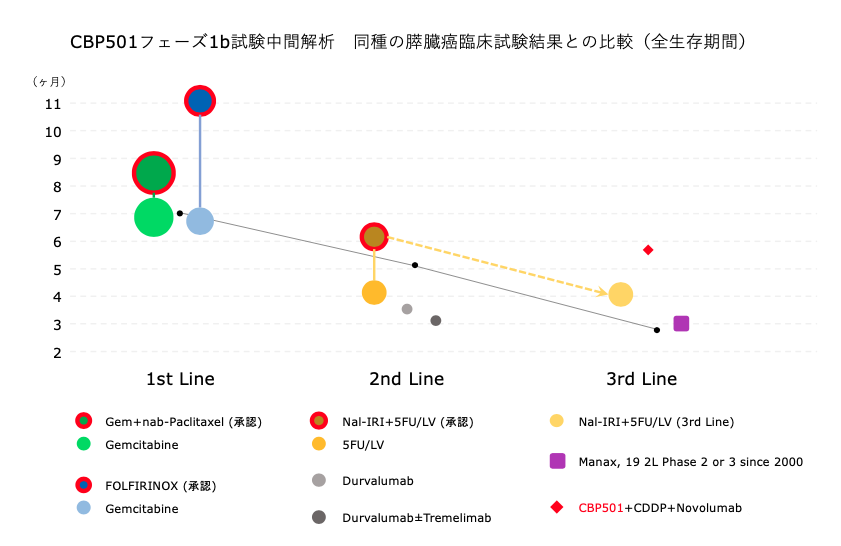
カラフルな丸はそれぞれ、臨床試験の群です。赤で囲んであるのは、そのデータを元にFDAがこの治療を承認したものです。
実線で縦に結ばれた複数の丸は、同一の臨床試験の中の群であることを示しています。
丸の大きさは症例数を表しています。症例数が多いほどデータの信頼性は高いと考えられます。
黒い小さな点を結んだ右下がりの線は、免疫チェックポイント抗体を含む治療のOSを1次治療・2次治療・3次治療で比較調査した論文 (Sun et al., Therapeutics and Clinical Risk Management 2018: 14 1691-1700) から取っています。
順に「7.0ヶ月」「5.1ヶ月」「2.8ヶ月」です。 このデータは以前もご紹介しました。
カラフルな丸を、左から順にご説明します。
緑色の2つの丸は、Gemcitabineとnab-Paclitaxelの併用が膵臓癌の1次治療薬として承認された際のPh3データです。
(余談ですが、この報告は、キャンバス科学顧問団チェアマン Dr. Von Hoff が筆頭著者として報告したものです。)
投与群(431例)のOSは8.5ヶ月、Gemcitabineを単独投与した対照群(430例)のOSは6.7ヶ月でした。
青い2つの丸は、FOLFIRINOX(5-FU・イリノテカン・オキサリプラチンの3つの抗癌剤に、5-FU増強剤レボホリナートを加えた4剤併用)が膵臓癌の1次治療薬として承認された際のPh3データです。
投与群(171例)のOSは11.1ヶ月、Gemcitabineを単独投与した対照群(171例)のOSは6.8ヶ月でした。
なお、この治療は相当にきついので、しっかりした体力のある患者さんしか受けられません。
2nd Lineの欄に縦に並んでいるオレンジ色系の2つの丸は、リポソームイリノテカン(Nal-IRI)と5-FU・ロイコボリン(5FU/LV)の併用が膵臓癌の2次治療薬として承認されたNAPOLI-1試験のPh3データです。
2次治療では、投与群(117例)のOSは6.2ヶ月、5FU/LVを投与した対照群(119例)のOSは4.2ヶ月でした。
このリポソームイリノテカンと5-FU・ロイコボリンの併用は、実際の医療で3rd Line(3次治療)として処方された場合のOSが4.1ヶ月であることが報告されており、これも右下の破線矢印の先に表示しました。
グレーの2つの丸は、最近行われた免疫チェックポイント抗体単独あるいは2剤併用の臨床試験のデータです。
3rd Lineの欄にある紫色の四角は他と少し性質が異なり、2次治療・3次治療で2000年以降に実施されたPh2・Ph3臨床試験19件のデータをまとめた結果です。
この図にCBP501フェーズ1b試験拡大相の中間解析データを載せたのが赤い◆です。
膵臓癌(評価可能8例)のOSの中央値は5.9ヶ月。
この8例中2例が2次治療、6例が3次治療です。
データを見る上で、症例数が少ないことにはもちろん留意しなければならず、さらに中間解析なので今後も数字の動く余地はまだ残っていますが、次相以降の試験を実施する価値は十分に示されたと考えています。
CBP501フェーズ1b試験は今後も継続します
さて、適時開示の後半に記載しているとおり、米国におけるコロナウイルス感染症(COVID-19)拡大は日本を上回る状況で、CBP501フェーズ1b拡大相試験の進行にも若干の影響が出始めています。
現在3か所あるCBP501臨床試験実施施設においては組入れ可能な状況が維持され、組入れが続いているものの、患者さんの移動が制限されていることなどで従前よりも遅いペースになっています。
また、新たな実施施設のオープンなどの組入れ促進策もとりづらくなっています。
さらに、組入れられたあと「評価可能」に至るまでには患者さんに数回にわたって通院していただく必要があるのですが、この移動に制約があるため、組入れられた症例が評価可能となる割合も低下が懸念されます。
そこでキャンバスでは、既に何度かお知らせしているとおり、学会発表や提携交渉での説得力、次相臨床試験の方針検討・設計・判断などの面で、今回適時開示した中間解析データまであっても大きな支障はないことから、
・現行の臨床試験は中断や延期・中止をせず、今後も継続する
・組入れ実現のペースを予測することは困難であり、積極的な組入れ促進策も実施が困難なため、具体的な組入れ完了目標時期を定めない
・・・とすることにしました。
今後、組入れの進行については、膵臓癌・MSS直腸大腸癌の各癌腫について完了(評価可能がそれぞれ10例に到達)した時点でお知らせします。
その中で獲得された新たなデータは、いずれ学会等で発表することになります。
今後追加されるデータの内容によって、たとえばこのあと奏効が複数出た場合に「大成功」に格上げする可能性は残っていますが、逆に現在の「中成功」から「小成功」に格下げになることはないと考えています。
記事を探す
- 未分類
カテゴリーから探す
タグから探す
- 学会発表
- 企業価値
- 競合
- 基礎研究
- 説明会
- 会社紹介
- マスメディア報道
- 余談
- 採用
- 加登住
- 提携獲得活動
- ご挨拶
- 臨床試験
- サイエンス
- 河邊
- 質疑応答
- ファイナンス
- 近況
- 適時開示
- 業界知識
- 決算説明
- 学会
- 日比野
- 決算
- 株主価値
- 株主総会
- 臨床開発
- お詫び
著書から探す
新着記事一覧
2024.05.14
2023.12.29
2023.10.24
2023.10.16
2023.10.01
よく読まれている記事
2023.02.24
2022.11.05
2023.12.29
2024.05.14
2023.10.24