マネジメントブログ
臨床試験データ比較検討の現場をお見せします(第4回)
前回のブログでは、比較可能な2つの臨床試験のデータを比較相手として、CBP501フェーズ1b試験の感触を探りました。
しかし、比較が2つだと説得力が今ひとつです。
また、ひとつひとつの比較で使っている母集団の数も小さいものばかりです。
それに、抗癌剤承認のゴールデンスタンダードである「全生存期間」についてはあまり比較ができていません。
今回は、集めることのできるデータ量の少なさを補って「全生存期間」で比較検討した事例をご紹介します。
※お願い:
本連載の初回に、本連載をお読みいただくにあたってご留意いただきたい点をまとめてあります。お手数ですが初回から順にお読みくださるようお願いします。
文献情報をもとに合理的に推定した数値と比較する
いずれ詳しくご説明するつもりですが、奏効率・病勢安定化率・無増悪生存期間は、データの取り方によって大きく数字が変わります。
それに比べて全生存期間は、さまざまな要因に左右されにくい(「工夫」の余地の少ない)指標です。
特に膵臓癌のように、期待される余命が短い場合ほど、数字のばらつきが少なくなります。
ましてや3回目治療となると、その後の治療による影響はほとんど無視できるくらい少なく、薬剤の実力が数字に反映されやすいと考えられます。
そこで、既治療膵臓癌の全生存期間についても比較検討を試みることにします。
もちろん、期待される生存期間は既治療歴によって異なります。
CBP501フェーズ1b試験と比較検討するには、3回目以降治療の情報が必要です。
しかし、ここで難問があります。
前回お話ししたとおり、膵臓癌は特に進行が早いので、臨床試験に関する文献などの情報は初回治療か2回目治療のものが大部分です。
3回目以降治療のものはとても少なく、そのままでは十分な比較に用いるための情報量を揃えることが困難なのです。
そこで、3回目以降治療の全生存期間がどれくらいかを見積もる材料として、公表されている2回目治療臨床試験の全生存期間(OS)から、それぞれの試験での無増悪生存期間(PFS)を引いた数字を使うことにしました。
通常、3回目治療は2回目治療で癌が進行した後に(つまり無増悪生存期間終了後に)行われます。
もし、すべての患者さんが2回目治療の無増悪生存期間終了後すぐに3回目治療を始めたとしたら、2回目治療の全生存期間から無増悪生存期間を引き算(OS – PFS)すれば、3回目治療の全生存期間が算出できます。
(但し実際には、3回目治療を受けないで亡くなる患者さんもおられるので話はそう単純ではありませんが。)
すぐに3回目治療を始めるケースばかりではないので、そのブランク期間のぶん、本来の3回目治療の全生存期間よりもやや大きく算出されるはずです。
それを並べたのが、こちらの図です。
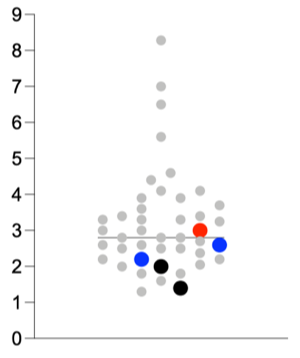
図の縦軸は、最近の総説(Yu et al, OncoTargets and Therapy, 2018:11 4591-4608)に記載されていた30試験の、群ごとの2回目治療臨床試験結果の全生存期間からそれぞれの群の無増悪生存期間を引いた数字(OS-PFS)です。
各試験の群数は1から3までさまざまです。
点ひとつひとつが各臨床試験の群ごとの結果で、点が大きく赤や青や黒になっているのは比較的大規模な試験の結果です。
この結果、3回目以降治療の全生存期間(中央値)は約2.9ヶ月と言えることがわかりました。
私たちの試験は現時点で、全生存期間の中央値5.6ヶ月。
(まだ途中なので、このあと、短くも長くもなる可能性があります。
また、くどいようですが、CBP501フェーズ1b試験は規模の小さい試験のデータなので、信頼性は高くないことにご留意ください。)
このグラフに「5.6ヶ月」の横線を引いてみると、かなり上位にあることがわかります。
したがって、やはり「好感触」と言って良さそうです。
✽ ✽ ✽
ところで、ご説明の中で「工夫」について触れたので、少し余談になりますがご説明しておきます。
臨床試験の登録要件(これが違うと極端にデータが変わります)の上では同じ患者さんでも、臨床的には患者さんごとにさまざまなので、組み入れる患者さんを上手に選別すれば見た目のデータを良くする工夫の余地はあります。
この「工夫の余地」についても、連載のあとのほうで触れるつもりです。
この「工夫」は一見、たとえば提携交渉を有利に進めるために、多少ずるいかもしれないけれどビジネスとしては絶対にやるべき工夫のように見えます。
しかし、これは諸刃の剣です。
本当は効いていない患者さんが効いているほうに入ってしまうことで、本来ならば気づくはずの重要な情報を見落としてしまうかもしれません。
たとえば私たちは、非小細胞肺癌臨床第2相試験の「失敗」のおかげで、それまで気づかなかったCBP501のさまざまな働きに気づき、次の(いま進めている)臨床試験に至りました。
もし「工夫」をしていたら、臨床第2相試験は「成功」したかもしれません。
しかし、CBP501のさまざまな働きに気づく機会もなかったでしょう。
それに気づかずあのまま臨床第3相試験に進んでいたら、百億円単位の資金を無駄にする壮大な失敗をしたかもしれません。
そんなふうに、良くないデータを良く見えるように工夫することが中長期的にはネガティブに働くこともあります。
ですから私たちは、今のところそういう工夫はしていません。
さて、本題に戻ります。
✽ ✽ ✽
前回と今回を合わせて、他の臨床試験との比較の事例を3つご紹介しました。
ところで、臨床試験の「感触」をつかむための比較相手は、他の進行中の臨床試験ばかりではありません。
「効果なし」とされた臨床試験の数字といくら比べてそれらより好感触だからといっても、それだけでは「どのくらい好感触か」のレベル感はつかめません。
どんぐりの背比べかもしれません。
それを補う方法として、FDAで近年承認された新薬についてその臨床試験データと比べることができれば、自分たちのデータがどのくらいのレベルの「好感触」なのか(たとえば、将来新薬承認を得られるレベルかどうか)を見ることができます。
また、比較ばかりでなく、
「『CBP501に狙いどおりの効果があるとすれば起きるはずのこと』が本当に生体内で起きているか」
を直接検討することによって、自分たちの薬剤の潜在力をよりきちんと把握することができます。
次回はそれらをご説明します。
(第5回に続く)
記事を探す
- 未分類
カテゴリーから探す
タグから探す
- 講演
- 学会発表
- 企業価値
- 競合
- 基礎研究
- 説明会
- 会社紹介
- マスメディア報道
- 余談
- 採用
- 加登住
- 提携獲得活動
- ご挨拶
- 臨床試験
- サイエンス
- 河邊
- 質疑応答
- ファイナンス
- 近況
- 適時開示
- 業界知識
- 決算説明
- 学会
- 日比野
- 決算
- 株主価値
- 株主総会
- 臨床開発
- お詫び
著書から探す
新着記事一覧
2025.04.29
2024.11.20
2024.11.13
2024.11.08
2024.10.08
よく読まれている記事
2024.11.20
2022.11.05
2023.02.24
2023.12.29
2024.05.14