マネジメントブログ
パラダイムシフト(その2)
2015年のAACR(米国癌研究会議)・ASCO(米国臨床癌学会)では、癌治療のパラダイムシフトが顕在化しました。
「顕在化した」と表現したのは、2015年のAACRでは、既にこの路線に沿って深い考察のなされた、興味深い研究成果が数多く発表されていたからです。
ご存じのとおり研究は、テーマに気づいてから一朝一夕のうちに成果を発表できるものではありません。今ようやく気がついて研究の方向性を変えるのでは、とても太刀打ちできません。
しかも、発表されていた研究成果の多くは、分子生物・免疫・コンピュータなどさまざまな分野の一流の研究者たちが数多くの臨床試験を行う医師たちと共同しなければできない内容です。2015年の発表の前に、長い潜在期間があったわけです。米国の底力をあらためて思い知りました。
それをご紹介する前に、少し話を遡ります。
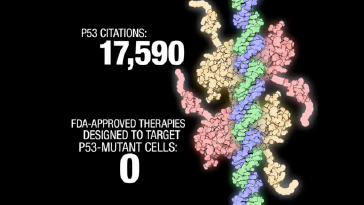
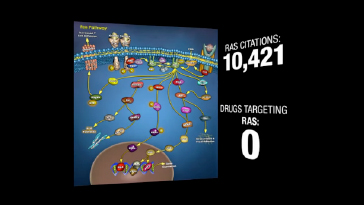
このふたつの画像は、2010年AACR年次総会のプロモーションビデオ “It’s Our Time” のスクリーンショットです。
「癌抑制遺伝子P53に関する科学論文は17,590件もあるのに、FDAに承認されたP53を標的とする癌治療法は『0』」
「発癌遺伝子RASに関する科学論文は10,421件もあるのに、RASを標的とする抗癌剤は『0』」
AACRはこうやって、科学者の奮起を促していました。 ”It’s Our Time”、「何をやってるんだ、俺たち基礎研究者の出番じゃないか」というわけです。
AACRの会場でこれを見た時、あらためて「頑張らなきゃ!」と、鳥肌が立ちました。
(全編にご興味あるかたはAACR公式YouTubeチャンネルで公開されている動画 https://youtu.be/3pobQRfz0No をぜひご覧ください。美しいインフォグラフィックスの多用された、正味4分ほどの動画です。)
2年後2012年のASCO年次総会では、目に止まった症例報告風のプレゼンテーションがありました。
(このプレゼンテーションは、ASCOのライブラリでご覧いただけます)
40歳女性、Facebook社従業員。癌以外に健康上の問題なし。
健康診断で大腸に腺癌が発見され、CTスキャンで肺と肝臓に多くの転移あり。
彼女はさっそくFacebookに投稿したそうです。
「ステージIVの大腸癌と診断されたけど、どうしたらいい?」
最初のコメント返信はこうでした。
「主治医に、個別化医療を受けたいと言いなさい」「主治医が治療ガイドラインに従う(科学的に認められた標準治療を実施してくれる)ことを確認しなさい」
Google検索をすると、「個別化医療・癌」で約298万件、「大腸癌・個別化医療」で約39万5千件がヒット。
個別化医療を受けるための遺伝子解析を行い、「癌遺伝子K-rasは野生型」「B-RAFのV600E変異がある」「VEGF-R2の発現は低い」「チミジル酸合成酵素は過剰発現している」といった結果が判明しました。
この結果を受けた癌専門医の見解はこうでした。
「唯一の合理的治療法はFOLFIRI」。
FOLFIRIとは、従来型の抗癌剤を3剤併用する処方です。[ Wikipedia ]
世界中の製薬会社が莫大な費用をかけて開発競争をしているはずの「いわゆる分子標的薬」は、彼女には何のメリットももたらしません。
彼女は例外的患者さんなのでしょうか? いいえ、そうではありません。
キャンバスのウェブサイトの中でもご紹介しているように、標的とした分子への依存度が大きい(バイパスが少ない)場合は分子標的型のアプローチは「癌を特異的に殺す」ための有効な手段であるものの、そうでない場合は、役に立ちません。
翌2013年のASCOのキーワードのひとつは“Pan Wild Type”でした。
「分子標的薬の標的となっている遺伝子変異がない」という意味。彼女のような「そうでない患者さん」の総称です。
Pan Wild Typeの比率は癌の種類によってさまざまですが、たとえば欧米の肺癌では実に8割以上にのぼります。彼女は決して、希な患者さんではないのです。
そもそも、2000年頃に慢性骨髄性白血病に著効を示して癌領域の分子標的薬時代の幕開けを飾ったイマチニブ(商品名:グリベック、ノバルティスファーマ)の登場まで、抗癌剤開発をしている製薬会社はとても少なかったのです。
理由は、高血圧や糖尿病などに比べ「患者数が少なく儲からない」「原因が複雑すぎて手に負えない」「毒性の高い薬にならざるを得ないので開発リスクが高い」。
彼らにとって、イマチニブの成功は衝撃でした。
生活習慣病に比べ何桁も少ない人数しかいない慢性骨髄性白血病患者さんへの薬が、その患者さんの「命」を延ばすことで、莫大な利益を生んだのです。
当然、彼らは色めき立ちました。
前回のブログでご紹介したように、分子標的薬時代の初期には「すべての癌に標的となる分子がいずれ見つかり、それぞれの分子標的薬が開発され、全ての癌を治す時代になる」と信じられていたので、標的となりそうな遺伝子変異は片っ端から開発テーマとなり、莫大な研究開発費が投入されました。
しかし、癌はそんなに単純なものではありません。いくつかの癌の数割には合致する「分子標的薬」が開発されましたが、多くの癌の大半ではそうなりませんでした。遺伝子変異が見つかっても、癌がその変異なしに生きられない慢性骨髄性白血病のようなケースは、むしろ例外的なのです。また、癌にとって必要不可欠な変異でも、癌抑制遺伝の場合のように「機能が無くなる」ことが重要である場合、薬剤でその機能を「回復」させることは不可能に近いのです。
そして現在に至るまで、製薬会社の莫大な開発費の多くは、既に誰かが分子標的薬を上市させたのと同じ対象患者さんに対する同様の薬剤を開発することにかけられるようになってきたのです。
企業としては当然の選択かもしれません。”Validated Target”(薬になることがわかっている標的)を狙ったほうが開発リスクは低く、かけたコストを回収できる可能性は高いでしょう。
しかし皆が皆それをやるようになってしまったことで、分子標的薬時代の以前から、そして今でも、Pan Wild Typeの患者さんたちは置き去りになってきたのです。
「残念ながらあなたの治療法はありません…治療法の開発競争すら行われていません。」
『ニューヨーカー』誌に1998年に掲載されたFrank Cothamの風刺画の光景は、現在も世界中で続いています。
前置きが長くなりました。
この光景を変えるかもしれないパラダイムシフトの顕在化した2015年ASCOのご報告は、次回に。
(「その3」につづく)
記事を探す
- 未分類
カテゴリーから探す
タグから探す
- 学会発表
- 企業価値
- 競合
- 基礎研究
- 説明会
- 会社紹介
- マスメディア報道
- 余談
- 採用
- 加登住
- 提携獲得活動
- ご挨拶
- 臨床試験
- サイエンス
- 河邊
- 質疑応答
- ファイナンス
- 近況
- 適時開示
- 業界知識
- 決算説明
- 学会
- 日比野
- 決算
- 株主価値
- 株主総会
- 臨床開発
- お詫び
著書から探す
新着記事一覧
2024.05.14
2023.12.29
2023.10.24
2023.10.16
2023.10.01
よく読まれている記事
2023.02.24
2022.11.05
2023.12.29
2024.05.14
2023.10.24