文字サイズ 小|中|大

2018.2.22 2018年6月期第2四半期決算説明会
2018年6月期第2四半期決算説明会資料(2018年2月22日)
Q. CBP501についてはフェーズ1b試験の結果を見てから提携交渉ということだが、試験終了の時期の目処はどうか。
A. (河邊)
試験終了は2019年の前半から半ばのうちにと考えている。
提携交渉の開始時期はそれとは異なる。
今回の試験はオープンラベル試験(データが日々見えている試験)なので、秘密保持契約を締結している先にはその内容を伝えることができる。
秘密保持契約先との間の間では試験終了を待たず日々の進捗に沿って提携交渉していくことになる。
Q. 提携交渉のメインの対象は免疫チェックポイント阻害剤を持っている大手製薬企業が中心と考えて良いか。
A. (河邊)
大手製薬企業とそうでない企業等の両方が対象で、強弱の違いはないと考えている。
免疫チェックポイント阻害剤を持っている大手製薬企業はさまざまな併用について多数の臨床試験を既に走らせ莫大な開発費を掛けていて、「もう併用はお腹いっぱい」という状態なことがある。
一方で、既に起きているように、結果が思わしくなく脱落していく併用臨床試験も少なくなく、そのほうが多くなれば新しい併用を改めて探す場面も出てくる。
また、既に多数の大手製薬企業が免疫チェックポイント阻害抗体を持っており、その競合のツールとして他にない併用薬を探すというケースも想定できる。
さらに、その動きに乗り遅れている製薬企業等は、今から一から始めても追いつけないので、多数の併用の中でどれかが頭一つ抜け出してくるのを待っているところもある。
そういった状況なので、さまざまなタイプの製薬企業等が提携のターゲットになり得る。
キャンバスとしては、「少しでも早く組んでいただける」というのも大きな要素でもあり、引き続き前広に提携活動を実施している。
Q. フェーズ1b試験について、先ほどの説明で
「詳しくは申し上げられないが最初のコホートの感触はとても良い」
という話があったが、現状の交渉で、その好感触の途中データを見せての反応はどうか。
A. (河邊)
感触についてのコメントは直近の情報を踏まえてのもの。
現状までの感触が良いと外向けに発信するのはこの説明会が初めて。
今後、守秘義務契約を締結している製薬企業等提携交渉先に具体的データを示しつつお伝えしていく。
Q. 他の大手製薬企業で免疫系抗癌剤の臨床試験があまり上手く行っておらず、傍目にはキャンバスにとって良好な外部環境と感じているのだが、提携交渉の現場での手応えはどうか。
A. (河邊)
まったくおっしゃるとおりと思っている。
外部環境がいいというのは間違いないし、たまたまかもしれないがCBP501フェーズ1b試験のスタートの感触も良い。
ただ、今回に限らず製薬企業等の反応にはタイムラグがあるので、いきなり提携成立に向けて急加速するとは限らない。
免疫系抗癌剤との併用に化学療法剤(プラチナ系など従来型の抗癌剤)が良いということを当社はかなり以前から言っており、業界でも併用候補のひとつに化学療法剤があることはかねてから言われていたが、医師向けのニュース等を毎日読んでいると、現場で治療にあたっている医師たちの見解の中でその候補としての順位が上がってきているのを最近は日々感じている。
Q. 現時点は、用量設定相で3症例ずつ用量を上げていく最初の3症例への投与が終わったということか。先ほどの説明だとフェーズ1b試験は2019年半ばまでの終了予定ということだが、ペースはどうか。
A. (河邊)
最初の3症例への投与が済んだところ。
用量設定フェーズでおそらく4段階。これが2018年半ばには終わる。
その後、決めた用量で、1つないし2つの疾患で拡大フェーズを進め、2019年半ばくらいに終了する計画。
(加登住)
用量設定フェーズと拡大フェーズでは症例組み入れの仕組みが大きく異なる。
用量設定フェーズでは3症例への投与で問題ないことを確認してから次のコホートへ進むが、拡大フェーズではヨーイドンで一斉に組み入れを始めるので、スピードが速まると想定している。
現在のスピード感と終了時期にズレを感じられるのはそのせいと思う。
Q. フェーズ1b試験の中間状況についてAACRやASCO、あるいはESMOでの発表は考えているか。
A. (河邊)
ASCOに間に合えば良かったのだが、6月のASCOの抄録〆切が2月初頭だったので間に合わなかった。
AACRはさらに前なので、今年のAACR・ASCOには間に合わない。
ESMOについては、可能性はあるものの、臨床試験の主導医たちがその気になるかどうか次第。
我々としては、ここまでくると学会発表や論文よりもビジネスミーティングへのデータ供給のほうが重要。
Q. CBP501の好感触について、TMB(Tumor Mutation Burden: 腫瘍組織中の遺伝子変異量の指標。遺伝子変異の多い症例では免疫チェックポイント阻害抗体が効きやすいことが示されている)との関係はどうか。
A. (河邊)
それはとても大きな話題で、まさに今回のフェーズ1b試験の評価にも繋がる。
TMBは、FDAが初めて癌腫別でなく「遺伝子変異の多い(=TMBの高い)患者さんが濃縮されているマイクロサテライト不安定性の高い(MSI-H)患者さんとミスマッチ修復異常(MMR deficiency)のある患者さん」に対する承認をしたことで注目されている。
先ほどCBP501フェーズ1b試験について「最初の感触が良い」と申し上げたが、たとえばふつう免疫系抗癌剤が効かないとされている癌であっても「TMBの高い患者さんが100人に1人存在する癌」の場合、その1人がたまたま臨床試験に入って来られたら効くので、「それはCBP501を併用したからだ=感触が良い」と勘違いするかもしれない。
したがってTMBはとても重要。
ただ、TMBの高い患者さんの比率は癌の種類ごとに大まかにわかっているので、たとえば高TMBが1%くらいしか存在しない癌の患者さん10人に投与して2人3人で効いたとしたら、それはTMBで説明がつかないと統計学的に判断できる。
Q. CBP501の作用メカニズムとして、TMBが低くても効く可能性は十分にあるのか。
A. (河邊)
おっしゃるとおり。
たとえばメルク社のキイトルーダを見ると、肺癌のファーストラインについてはもともとPD-L1が多く発現している患者さんのみで承認されたが、化学療法剤との併用についてはその制限がない。
その根底にあるのは、化学療法剤は突然変異を増やすので、それでTMBを高めるという発想。
対象患者さんを絞り込まなくてもよい=免疫系抗癌剤の恩恵を受ける患者さんの比率が高まるという意味で、化学療法剤併用には魅力がある。
Q. CBP501が好感触と言っている根拠は、最初のコホートの3人全部に効いたということか。それとも1人とか2人に効いたのか。
A. (河邊)
3人のうち1人に効いただけだったらこんなに嬉しそうな顔をしていない(笑)
ただ、ジャンケンに3回続けて勝つことはある。最初の3人が良くてもその後が全然ダメということもあるので、まったく確証にはならない。
とは言え、今のところ3人の結果はおかげさまで感触が良い。
この段階での感触の良し悪しは今後の臨床試験の進行スピードにも大きく影響するので、好材料と考えている。
Q. CBP501の臨床試験に入っている癌の種類の実績は公表できるか。
A. (河邊)
今のところは差し控える。
Q.Stemline社からの技術アドバイザリーフィー受領期間の終了が近づいているが、継続の可能性はあるのか。また、アドバイザリーの内容はどのようなものか。
A. (加登住)
技術アドバイザリーフィーは2018年12月までという契約。
当社の決算では2018年6月期は1年分、2019年6月期は約6ヶ月分の事業収益が計上されて技術アドバイザリーフィーの期間は終了となる。
臨床試験の進行上の都合などで新たな技術アドバイザリーの必要性が発生したときに期間延長される可能性がないわけではないが、原契約の枠組みの中にあらかじめ盛り込まれている期間延長条項はない。
(河邊)
臨床試験に入る前までのデータは我々が取ったものであり、論文になっていない部分も含めた化合物の特性などについて我々が持っている情報を提供している。
具体的な例としては、
「化合物の大量合成をしている合成経路について改善の余地があるかどうか・どの点が改善の余地か」
「臨床試験で出てきた細かい副作用とCBS9106の特性との間にひょっとして関係があるのではないか」
といった、ひとつひとつは細かいものの幅広い問い合わせへの対応が技術アドバイザリーの範疇。
Q. 臨床第1相試験が長引いているが、マイルストーンも遅れるのか。
A. (河邊)
マイルストーンがどのイベントで発生するかは公表していないので、具体的な回答は差し控える。
Q. 血液癌への適応拡大について以前から触れられているが、それに関する進捗はないか。臨床試験はいつ頃から始まる予定か。
A. (河邊)
血液癌、特に多発性骨髄腫については、非臨床試験の結果を踏まえて当初から視野に入っていた。
Stemline社が公表しているとおり、固形癌と並行して途中からスタートするということで準備が進められている。
いつ始めるのか・本当に始めるのかについては、我々は知らない。
ただ、競合先であるKaryopharm社は多発性骨髄腫で良い結果が出ている旨の報告をしており、Stemline社が血液癌に進む後押しとなると考えている。
また、固形癌と血液癌の開始タイミングをずらしている背景には、ファースト・イン・ヒューマンの試験なので開発の初期に大きな副作用が出るリスクがあり、それを固形癌で見極めてから血液癌をスタートさせたいという考えがあったと思われる。
その見極めはそろそろできていて、血液癌の臨床試験を開始する障害は減っているのではないかと考えている。
(加登住)
「本当に始めるのか」について補足すると、Stemline社は先般比較的大きな公募増資に成功しており、その際に使用されたプレゼンテーションにSL-801(CBS9106)を血液癌へ展開予定と記載されているので、「たぶん本当に始めるだろう」と思っていて良いと考えている。
Q. 血液癌の臨床試験が始まることは元の契約に盛り込まれているのか。
A. (加登住)
開発早期の化合物のライセンス契約では、将来の開発が適応や地域で枝分かれするのを想定してあるのが一般的。
その分岐の要所要所にマイルストーン対象イベントを設定するのも一般的なやりかたで、Stemline社との契約も概ねそういった形になっている。
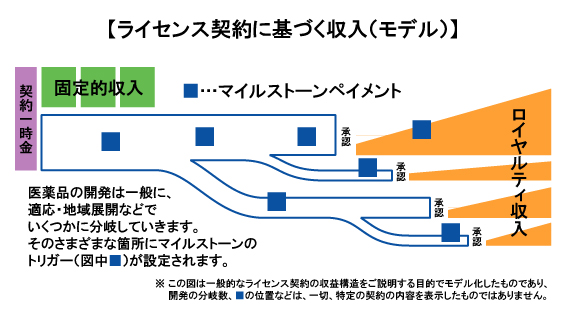
たとえば「血液癌の臨床試験開始」がマイルストーン対象イベントになっているかどうかといったご質問には回答できない。
Q. 小野薬品とKaryopharm社の大型ディール発表によってCBS9106に集まる関心は変化したか。
A. (河邊)
あの発表があったからというわけではなく、あの発表の少し前から感触が変わっている。
Q. CBS9106が第1相試験第8コホートまで進んでいることについてキャンバスとしては順調と見ているのか。
A. (河邊)
第8コホートで50mg/日という用量まで進んでいることを我々は喜んでいる。
ここまで来て目立った副作用がなく安全性と有効域が確保できているということは、何かの癌腫で効いてもおかしくない。
体力とやる気のある会社であれば結果が出るまでいろいろ試して承認まで持っていくレベルまで来ている。
Q. 富士フイルムとの共同研究について、現在の進捗や成果はどうか。
A. (河邊)
具体的な標的を決め、それに対する探索活動をしている。
先方との関係もあり、それ以上の詳細な回答は難しい。
しっかりした企業との共同研究であり、キャンバスの研究者たちも良い緊張感を持って活動できている。
Q. 中間的な進捗についてリリースできる可能性はあるか。
A. (河邊)
相手先のある話でもあり、軽々しくリリースはできない。
たとえば前臨床試験に進むベスト化合物が決まればリリースになると思うが、それまでのいずれかの段階で何らかのリリースができるかどうかは先方との相談。