マネジメントブログ
フェーズ1b臨床試験の開始承認取得
本日、CBP501臨床試験(フェーズ1b試験)開始承認(IND)の取得を公表できたことを、大変嬉しく思っています。
今回の臨床試験にかける私たちの意気込みは、これまで以上に大きなものです。
というのも、今回の臨床試験は、このブログで2年近くも前から私たちが言い続けていた抗癌剤のパラダイムシフトの主役である「免疫チェックポイント抗体」とCBP501との併用による安全性と有効性を示そうとする、成功時のインパクトの極めて大きな試みだからです。
今回の臨床試験の併用は、CBP501、シスプラチン、そして抗PD-1抗体ニボルマブ(商品名オプジーボ®)の3剤です。
ニボルマブをはじめとする既承認の免疫チェックポイント抗体の弱点は、恩恵を受ける患者さんの比率が未だ比較的小さいことです。
もちろん、たとえば進行してしまった肺癌でも20%前後の患者さんの余命を数年単位(もしかしたら、治癒も望めるかも知れない)で延ばせるのは、物凄いことです。
とはいえ、これを40%や50%に増やすことができればどれほど素晴らしいでしょう。
また、現在は免疫系抗癌剤の恩恵を受ける患者さんの比率が小さすぎて承認には至らない他の癌(たとえば膵臓癌など)についても、治療効果を高めることができれば、悪性黒色腫や肺癌のようにより多くの患者さんの余命を延ばすことが可能になるかもしれません。
キャンバスの候補化合物CBP501は、これまでの非臨床試験で、シスプラチン・免疫チェックポイント抗体の併用で作用が増強されることを示すデータを得ています。
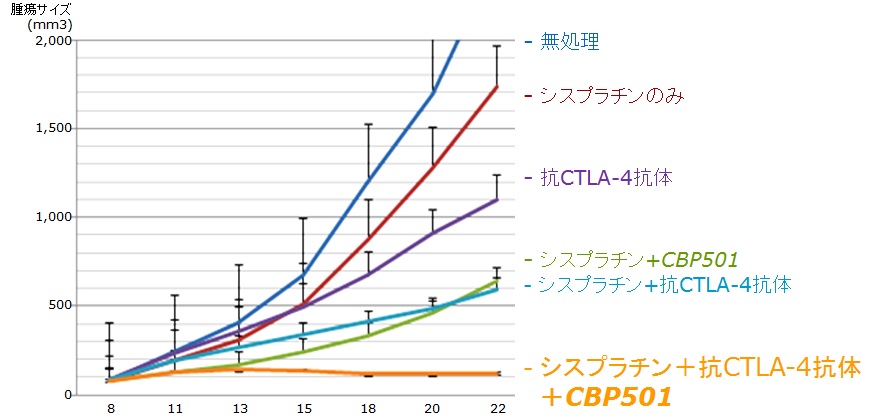
これと同様の効果をヒト臨床試験で示すことができれば、免疫チェックポイント抗体の恩恵を受ける患者さんの比率をCBP501が増大させる可能性を示すことになります。
私たちは、そうした結果が得られるという強い確信をもって今回のフェーズ1b試験に臨みます。
昨年9月の「資金使途の変更に関するお知らせ」公表以来、これまで私たちは、急ピッチでフェーズ1b臨床試験開始の準備を進めて来ました。
その間、不運も幸運もさまざまありましたが、全体として見ると、おかげさまで概ね順調に準備を進めてくることができたと思います。
今回FDAからの臨床試験開始承認(IND)を受け、これから臨床試験実施サイト(米国内の複数の医療施設での実施を計画しています)との契約等の手続を進めることになります。
それが済めばいよいよ患者さんの組み入れです。
まずは、一日も早い投与開始(「最初の症例組み入れ」という意味でFPI: First Patient Inといいます)を目指してまいります。
記事を探す
- 未分類
カテゴリーから探す
タグから探す
- 学会発表
- 企業価値
- 競合
- 基礎研究
- 説明会
- 会社紹介
- マスメディア報道
- 余談
- 採用
- 加登住
- 提携獲得活動
- ご挨拶
- 臨床試験
- サイエンス
- 河邊
- 質疑応答
- ファイナンス
- 近況
- 適時開示
- 業界知識
- 決算説明
- 学会
- 日比野
- 決算
- 株主価値
- 株主総会
- 臨床開発
- お詫び
著書から探す
新着記事一覧
2023.12.29
2023.10.24
2023.10.16
2023.10.01
2023.09.27
よく読まれている記事
2023.02.24
2022.11.05
2023.12.29
2023.10.24
2022.09.07